Soal kalorimeter dan pembahasan.
Jika kamu sedang mencari artikel soal kalorimeter dan pembahasan terlengkap, berarti kamu telah berada di website yang benar. Yuk langsung aja kita simak ulasan soal kalorimeter dan pembahasan berikut ini.
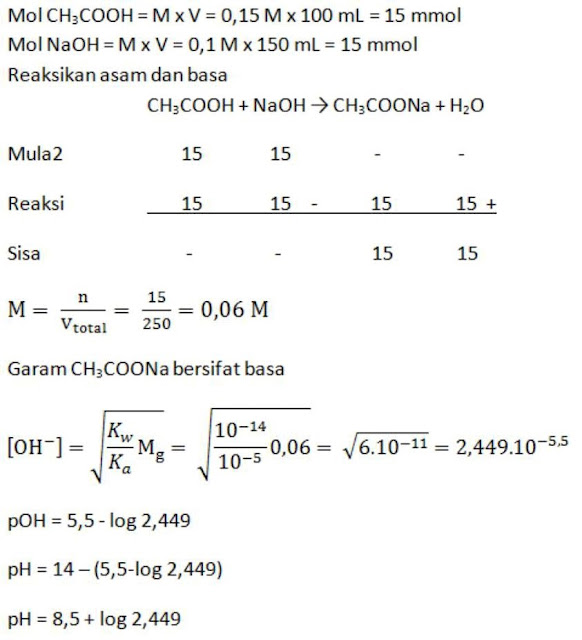 Larutan CH3COOH 0,15 M yang volumenya 100 mL dicampur From primalangga.com
Larutan CH3COOH 0,15 M yang volumenya 100 mL dicampur From primalangga.com
Bila suhu air kalorimeter menjadi 65°c dan kalor jenis air adalah 4,2 j/gc.
Didalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (ch4) dengan oksigen berlebihan , sehingga terjadi reaksi, ch4(g) + 2 o2(g) — co2(g) + 2h2o (g) ternyata terjadi kenaikan suhu 1,56oc. Dalam kalorimeter yang telah dikalibrasi dan terbuka direaksikan 50g alkohol dan 3g logam natrium. M = 250 gram c es = 0,5 kal/gr°c l es = 80 kal/gram Bila suhu air kalorimeter menjadi 65°c dan kalor jenis air adalah 4,2 j/gc. Es bermassa 250 gram bersuhu − 5° c dipanasi hingga melebur menjadi air bersuhu 0°c.
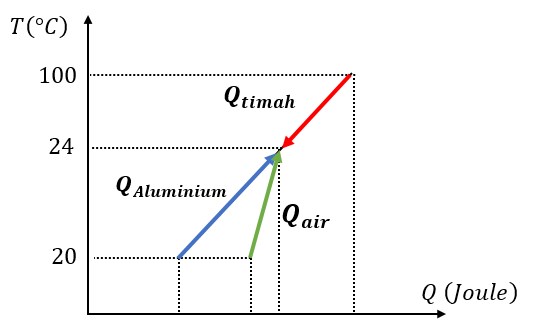 Source: gammafisblog.com
Source: gammafisblog.com
Didalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (ch4) dengan oksigen berlebihan , sehingga terjadi reaksi, ch4(g) + 2 o2(g) — co2(g) + 2h2o (g) ternyata terjadi kenaikan suhu 1,56oc. Dalam kalorimeter yang telah dikalibrasi dan terbuka direaksikan 50g alkohol dan 3g logam natrium. Ba+2hcl→ bacl 2 + h 2. Semoga artikel ini bisa menambah wawasan serta informasi anda. Mol oksalat = 90/90 = 1 mol.
Academia.edu is a platform for academics to share research papers.
Ba+2hcl→ bacl 2 + h 2. Tahap awal cara pemakaiannya adalah mengukur suhu pereaksi. Didalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (ch4) dengan oksigen berlebihan , sehingga terjadi reaksi, ch4(g) + 2 o2(g) — co2(g) + 2h2o (g) ternyata terjadi kenaikan suhu 1,56oc. Semoga artikel ini bisa menambah wawasan serta informasi anda.
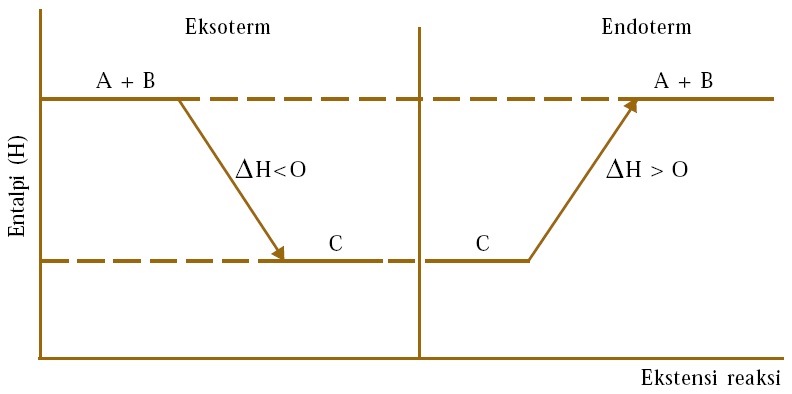 Source: materikimia.com
Source: materikimia.com
Posted in kimia tagged contoh soal entalpi termodinamika, contoh soal hukum hess, contoh soal termokimia, energi ikatan, entalpi ikatan adalah, entalpi pembentukan, entalpi penguraian standar, entalpi standar adalah, grafik entalpi reaksi, hubungan kalor dan entalpi, kalorimeter kimia, makalah termokimia, materi termokimia pdf, pengertian. Jika kalor jenis es 0,5 kal/gr°c, dan kalor lebur es adalah 80 kal/gr, tentukan kalor yang diperlukan untuk proses tersebut! Sesaat setelah pereaksi dicampurkan, maka reaksi selesai dan suhu hasil campuran diukur. Jika sepotong logam barium direaksikan dengan asam klorida encer pada sistem terbuka dengan reaksi:
 Source: qwerty.co.id
Source: qwerty.co.id
Jika kalor jenis es 0,5 kal/gr°c, dan kalor lebur es adalah 80 kal/gr, tentukan kalor yang diperlukan untuk proses tersebut! Tentukan entalpi pembakaran standar metanol (mr = 16) sebanyak 0,48 gram yang dibakar dalam kalorimeter yang berisi 500 gram air dan terjadi peningkatan suhu sebesar 15⁰c. Jika sepotong logam barium direaksikan dengan asam klorida encer pada sistem terbuka dengan reaksi: Tahap awal cara pemakaiannya adalah mengukur suhu pereaksi.
 Source: primalangga.com
Source: primalangga.com
Didalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (ch4) dengan oksigen berlebihan , sehingga terjadi reaksi, ch4(g) + 2 o2(g) — co2(g) + 2h2o (g) ternyata terjadi kenaikan suhu 1,56oc. Hitunglah kenaikan suhu kalorimeter yang terjadi. Hanya saja kalornya tidak bisa ditransfer ke lingkungan. Ba+2hcl→ bacl 2 + h 2.
Menentukan perubahan entalpi reaksi dengan kalorimeter soal 46 dalam kalorimeter bom yang memiliki kapasitas (nilai air) 125 j/ °c dan berisi 200 ml air dengan suhu 25°c dibakar sempurna 8 gram gas metana ch4 (mm=16 gram/mol).
Demikian pembahasan yang menarik mengenai kalorimeter mulai dari pengertian, fungsi dan prinsip kerja. Jika kalor jenis es 0,5 kal/gr°c, dan kalor lebur es adalah 80 kal/gr, tentukan kalor yang diperlukan untuk proses tersebut! Bila suhu air kalorimeter menjadi 65°c dan kalor jenis air adalah 4,2 j/gc. Posted in kimia tagged contoh soal entalpi termodinamika, contoh soal hukum hess, contoh soal termokimia, energi ikatan, entalpi ikatan adalah, entalpi pembentukan, entalpi penguraian standar, entalpi standar adalah, grafik entalpi reaksi, hubungan kalor dan entalpi, kalorimeter kimia, makalah termokimia, materi termokimia pdf, pengertian. Dalam kalorimeter yang telah dikalibrasi dan terbuka direaksikan 50g alkohol dan 3g logam natrium.
 Source: qwerty.co.id
Source: qwerty.co.id
Semoga artikel ini bisa menambah wawasan serta informasi anda. Sesaat setelah pereaksi dicampurkan, maka reaksi selesai dan suhu hasil campuran diukur. Jika suhu awal campuran 30°c dan setelah reaksi suhunya 75°c, tentukan δhreaksi. Tahap awal cara pemakaiannya adalah mengukur suhu pereaksi. Pada reaksi tersebut sistem melepas kalor sebesar 150 kj dan menghasilkan gas yang akan menyebabkan terjadinya perubahan volume, sistem ini juga.
Kalor jenis air 4,18 j/g o c).
Didalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (ch4) dengan oksigen berlebihan , sehingga terjadi reaksi, ch4(g) + 2 o2(g) — co2(g) + 2h2o (g) ternyata terjadi kenaikan suhu 1,56oc. M = 250 gram c es = 0,5 kal/gr°c l es = 80 kal/gram Semoga artikel ini bisa menambah wawasan serta informasi anda. (ar c = 12, o = 16, h = 1) pembahasan :
 Source: qwerty.co.id
Source: qwerty.co.id
Bila suhu air kalorimeter menjadi 65°c dan kalor jenis air adalah 4,2 j/gc. M = 250 gram c es = 0,5 kal/gr°c l es = 80 kal/gram Demikian pembahasan yang menarik mengenai kalorimeter mulai dari pengertian, fungsi dan prinsip kerja. Saat ini, kalorimeter reaksi menggunakan cangkir styrofoam (suatu isolator yang baik), namun masih ada juga kalorimeter buatan lama yang menggunakan cangkir aluminium.
 Source: materikimia.com
Source: materikimia.com
Karena disini akan mengulas tentang pengertian termokimia, sistem termokimia, dan rumus termokimia beserta contohnya secara lengkap. Hitunglah kenaikan suhu kalorimeter yang terjadi. Academia.edu is a platform for academics to share research papers. (ar c = 12, o = 16, h = 1) pembahasan :
 Source: primalangga.com
Source: primalangga.com
Dalam kalorimeter yang telah dikalibrasi dan terbuka direaksikan 50g alkohol dan 3g logam natrium. Hanya saja kalornya tidak bisa ditransfer ke lingkungan. Tahap awal cara pemakaiannya adalah mengukur suhu pereaksi. Academia.edu is a platform for academics to share research papers.
Posted in kimia tagged contoh soal entalpi termodinamika, contoh soal hukum hess, contoh soal termokimia, energi ikatan, entalpi ikatan adalah, entalpi pembentukan, entalpi penguraian standar, entalpi standar adalah, grafik entalpi reaksi, hubungan kalor dan entalpi, kalorimeter kimia, makalah termokimia, materi termokimia pdf, pengertian.
Hitunglah kenaikan suhu kalorimeter yang terjadi. Sesaat setelah pereaksi dicampurkan, maka reaksi selesai dan suhu hasil campuran diukur. Jika anda belum mengetahui nya anda tepat sekali mengunjungi gurupendidikan.com. Pada reaksi tersebut sistem melepas kalor sebesar 150 kj dan menghasilkan gas yang akan menyebabkan terjadinya perubahan volume, sistem ini juga. Es bermassa 250 gram bersuhu − 5° c dipanasi hingga melebur menjadi air bersuhu 0°c.
 Source: primalangga.com
Source: primalangga.com
Academia.edu is a platform for academics to share research papers. Kalor jenis air 4,18 j/g o c). Dalam kalorimeter yang telah dikalibrasi dan terbuka direaksikan 50g alkohol dan 3g logam natrium. Menentukan perubahan entalpi reaksi dengan kalorimeter soal 46 dalam kalorimeter bom yang memiliki kapasitas (nilai air) 125 j/ °c dan berisi 200 ml air dengan suhu 25°c dibakar sempurna 8 gram gas metana ch4 (mm=16 gram/mol). Karena disini akan mengulas tentang pengertian termokimia, sistem termokimia, dan rumus termokimia beserta contohnya secara lengkap.
Tentukan entalpi pembakaran standar metanol (mr = 16) sebanyak 0,48 gram yang dibakar dalam kalorimeter yang berisi 500 gram air dan terjadi peningkatan suhu sebesar 15⁰c.
Semoga artikel ini bisa menambah wawasan serta informasi anda. (ar c = 12, o = 16, h = 1) pembahasan : Dalam kalorimeter yang telah dikalibrasi dan terbuka direaksikan 50g alkohol dan 3g logam natrium. Kalor jenis air 4,18 j/g o c).
 Source: qwerty.co.id
Source: qwerty.co.id
(ar c = 12, o = 16, h = 1) pembahasan : Jika anda belum mengetahui nya anda tepat sekali mengunjungi gurupendidikan.com. (ar c = 12, o = 16, h = 1) pembahasan : Demikian pembahasan yang menarik mengenai kalorimeter mulai dari pengertian, fungsi dan prinsip kerja.
 Source: primalangga.com
Source: primalangga.com
Jika kalor jenis es 0,5 kal/gr°c, dan kalor lebur es adalah 80 kal/gr, tentukan kalor yang diperlukan untuk proses tersebut! (ar c = 12, o = 16, h = 1) pembahasan : Pada reaksi tersebut sistem melepas kalor sebesar 150 kj dan menghasilkan gas yang akan menyebabkan terjadinya perubahan volume, sistem ini juga. Bila suhu air kalorimeter menjadi 65°c dan kalor jenis air adalah 4,2 j/gc.
 Source: materikimia.com
Source: materikimia.com
Mol oksalat = 90/90 = 1 mol. Berikut ini adalah beberapa contoh soal kalorimeter beserta pembahasannya yakni sebagai berikut: Dalam kalorimeter yang telah dikalibrasi dan terbuka direaksikan 50g alkohol dan 3g logam natrium. (ar c = 12, o = 16, h = 1) pembahasan :
Saat ini, kalorimeter reaksi menggunakan cangkir styrofoam (suatu isolator yang baik), namun masih ada juga kalorimeter buatan lama yang menggunakan cangkir aluminium.
Didalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (ch4) dengan oksigen berlebihan , sehingga terjadi reaksi, ch4(g) + 2 o2(g) — co2(g) + 2h2o (g) ternyata terjadi kenaikan suhu 1,56oc. Berikut ini adalah beberapa contoh soal kalorimeter beserta pembahasannya yakni sebagai berikut: Tentukan entalpi pembakaran standar metanol (mr = 16) sebanyak 0,48 gram yang dibakar dalam kalorimeter yang berisi 500 gram air dan terjadi peningkatan suhu sebesar 15⁰c. M = 250 gram c es = 0,5 kal/gr°c l es = 80 kal/gram (ar c = 12, o = 16, h = 1) pembahasan :
 Source: materikimia.com
Source: materikimia.com
Hitunglah kenaikan suhu kalorimeter yang terjadi. Menentukan perubahan entalpi reaksi dengan kalorimeter soal 46 dalam kalorimeter bom yang memiliki kapasitas (nilai air) 125 j/ °c dan berisi 200 ml air dengan suhu 25°c dibakar sempurna 8 gram gas metana ch4 (mm=16 gram/mol). M = 250 gram c es = 0,5 kal/gr°c l es = 80 kal/gram Kalor jenis air 4,18 j/g o c). Saat ini, kalorimeter reaksi menggunakan cangkir styrofoam (suatu isolator yang baik), namun masih ada juga kalorimeter buatan lama yang menggunakan cangkir aluminium.
Jika sepotong logam barium direaksikan dengan asam klorida encer pada sistem terbuka dengan reaksi:
Jika sepotong logam barium direaksikan dengan asam klorida encer pada sistem terbuka dengan reaksi: Es bermassa 250 gram bersuhu − 5° c dipanasi hingga melebur menjadi air bersuhu 0°c. M = 250 gram c es = 0,5 kal/gr°c l es = 80 kal/gram Mol oksalat = 90/90 = 1 mol.
 Source: materikimia.com
Source: materikimia.com
Semoga artikel ini bisa menambah wawasan serta informasi anda. Dalam kalorimeter yang telah dikalibrasi dan terbuka direaksikan 50g alkohol dan 3g logam natrium. Saat ini, kalorimeter reaksi menggunakan cangkir styrofoam (suatu isolator yang baik), namun masih ada juga kalorimeter buatan lama yang menggunakan cangkir aluminium. Menentukan perubahan entalpi reaksi dengan kalorimeter soal 46 dalam kalorimeter bom yang memiliki kapasitas (nilai air) 125 j/ °c dan berisi 200 ml air dengan suhu 25°c dibakar sempurna 8 gram gas metana ch4 (mm=16 gram/mol). Hitunglah kenaikan suhu kalorimeter yang terjadi.
 Source: qwerty.co.id
Source: qwerty.co.id
Berikut ini adalah beberapa contoh soal kalorimeter beserta pembahasannya yakni sebagai berikut: Jika suhu awal campuran 30°c dan setelah reaksi suhunya 75°c, tentukan δhreaksi. Ba+2hcl→ bacl 2 + h 2. Es bermassa 250 gram bersuhu − 5° c dipanasi hingga melebur menjadi air bersuhu 0°c. Didalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (ch4) dengan oksigen berlebihan , sehingga terjadi reaksi, ch4(g) + 2 o2(g) — co2(g) + 2h2o (g) ternyata terjadi kenaikan suhu 1,56oc.
 Source: gammafisblog.com
Source: gammafisblog.com
Hitunglah kenaikan suhu kalorimeter yang terjadi. Jika kalor jenis es 0,5 kal/gr°c, dan kalor lebur es adalah 80 kal/gr, tentukan kalor yang diperlukan untuk proses tersebut! Hanya saja kalornya tidak bisa ditransfer ke lingkungan. (ar c = 12, o = 16, h = 1) pembahasan : Karena disini akan mengulas tentang pengertian termokimia, sistem termokimia, dan rumus termokimia beserta contohnya secara lengkap.
Situs ini adalah komunitas terbuka bagi pengguna untuk mencurahkan apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini lengkap, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga simpan halaman blog ini dengan judul soal kalorimeter dan pembahasan dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.





