Contoh soal perubahan entalpi dengan kalorimeter.
Jika kamu sedang mencari artikel contoh soal perubahan entalpi dengan kalorimeter terlengkap, berarti kamu telah berada di website yang tepat. Yuk langsung saja kita simak penjelasan contoh soal perubahan entalpi dengan kalorimeter berikut ini.
 √ 2 Rumus Keliling Lingkaran Contoh Soal Keliling Lingkaran From pintarnesia.com
√ 2 Rumus Keliling Lingkaran Contoh Soal Keliling Lingkaran From pintarnesia.com
Agar kalian dapat lebih jelas memahami perhitungan perubahan entalpi berdasarkan percobaan menggunakan kalorimeter, berikut diberikan beberapa contoh soal.
Entalpi reaksi ditentukan dengan cara memakai sebuah alat yang disebut kalorimeter (alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan atau reaksi kimia.). Pada pengamatan yang telah dilakukan sesuai dengan teori. Ke dalam kalorimeter sederhana direaksikan 25 ml larutan h 2 so 4 0,5 m dan 25 ml koh 1,0 m pada suhu 23,5 o c. Isooktana (c 8 h 18 ) adalah salah satu komponen yang ada dalam bensin, Proses dan cara menghitung perubahan entalpi atau entalpi reaksi $(\triangle\mbox{h})$, yakni selisih antara entalpi produk dan entalpi reaktan.
 Source: soal-kelasmu.blogspot.com
Source: soal-kelasmu.blogspot.com
Jenis perubahan entalpi perubahan entalpi pembentukan (δhf) ialah pergantian entalpi yang membentuk 1mol senyawa yang terjadi akibat beberapa unsur yang disusun oleh keadaan standar. C = kalor jenis air (4,18 j/gr.c) ∆t = perubahan suhu; Pengukuran di dalam termodinamika tidak dinyatakan dengan besaran mikroskopis melainkan dengan. Pengukuran perubahan entalpi suatu reaksi kadangkala tidak dapat ditentukan langsung dengan kalorimeter, misalnya penentuan perubahan entalpi pembentukan standar (dhf o )co. Aggar lebih jelas perhatikan contoh soal menentukan perhitungan entalpi dengan kalorimeter berikut ini.
Perhitungan yang digunakan pada pada kalorimeter menggunakan perhitungan dari teori asas black dengan rumus:
Ba+2hcl→ bacl 2 + h 2. Reaksi pembakaran selalu melibatkan gas oksigen (o 2) dan gas karbon dioksida untuk pembakaran sempurna atau gas karbon monoksida untuk pembakaran tidak sempurna.perhatikan contoh soal entalpi pembakaran. Pengukuran perubahan entalpi suatu reaksi kadangkala tidak dapat ditentukan langsung dengan kalorimeter, misalnya penentuan perubahan entalpi pembentukan standar (dhf o )co. Reaksi pembakaran karbon tidak mungkin hanya menghasilkan gas co saja tanpa disertai terbentuknya gas co 2.
 Source: slideshare.net
Source: slideshare.net
Pengertian umum untuk kalorimeter adalah alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan atau reaksi kimia. Dengan adanya pengembangan lead chamber process pada tahun 1746 dan proses leblanc, sehingga memungkinkan adanya produksi asam sulfat dan natrium karbonat dalam jumlah besar, maka reaksi kimia dapat diaplikasikan dalam industri. Lima puluh gram airlima puluh gram air pada wadah lain dipanaskan, kemudian sesaat sebelum dimasukkan ke dalam kalorimeter suhunya diukur dan ternyata besarnya 70.5oc. C = kalor jenis air (4,18 j/gr.c) ∆t = perubahan suhu;
 Source: pintarnesia.com
Source: pintarnesia.com
Contoh soal, soal latihan dan soal evaluasi. 100 ml larutan h 2 so 4 1 m direaksikan dengan 100 ml naoh 2 dalam suatu kalorimeter sederhana, ternyata suhu larutan naik dari 25 ºc menjadi 45 ºc. (anggaplah bahwa massa jenis larutan 1 g/ml dan kalor jenis larutan 4,2 j/g k) Contoh soal menentukan perubahan entalpi contoh soal kalorimetri.
 Source: soal-kelasmu.blogspot.com
Source: soal-kelasmu.blogspot.com
Energi yang berkait dengan pemutusan atau pembentukan ikatan kimia. Reaksi kesetimbangan n 2 + 3h 2 ⇄2nh 3 menghasilkan 1 mol h 2 pada keadaan setimbang. Di dalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (ch 4) dengan oksigen berlebih, sehingga terjadi reaksi sebagai berikut: Aggar lebih jelas perhatikan contoh soal menentukan perhitungan entalpi dengan kalorimeter berikut ini.
Hitunglah perubahan entalpi reaksi yang terjadi.
Perhitungan yang digunakan pada pada kalorimeter menggunakan perhitungan dari teori asas black dengan rumus: Entalpi reaksi ditentukan dengan cara memakai sebuah alat yang disebut kalorimeter (alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan atau reaksi kimia.). Menentukan besarnya energi yang diserap atau dibebaskan oleh air dengan kalorimeter. Isooktana (c 8 h 18 ) adalah salah satu komponen yang ada dalam bensin, Apabila kalor jenis air 4,2 j/gr.ºc dan kalor kalorimetri 80 j/ºc maka tentukan δh reaksi :
 Source: slideshare.net
Source: slideshare.net
Pengertian umum untuk kalorimeter adalah alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan atau reaksi kimia. Dengan kata lain, jika kamu membalik satu atau lebih persamaan reaksi pembentukanmu agar produk dan reaktan saling meniadakan, gantilah tanda entalpi dari reaksi pembentukan yang kamu tukar. Contoh soal lima puluh gram air dimasukkan ke dalam sebuah kalorimeter. Istilah ini diperkenalkan sekitar 1762 oleh joseph black. Pada pengamatan yang telah dilakukan sesuai dengan teori.
Setelah memahami materi mengenai termokimia, sekarang kita lanjut ke contoh soal dan pembahasannya yuk!
Dengan kata lain, jika kamu membalik satu atau lebih persamaan reaksi pembentukanmu agar produk dan reaktan saling meniadakan, gantilah tanda entalpi dari reaksi pembentukan yang kamu tukar. Dengan kata lain, jika kamu membalik satu atau lebih persamaan reaksi pembentukanmu agar produk dan reaktan saling meniadakan, gantilah tanda entalpi dari reaksi pembentukan yang kamu tukar. Dalam contoh di atas, perhatikan bahwa reaksi pembentukan yang kita gunakan untuk c 2 h 5 oh terbalik. Pada reaksi tersebut sistem melepas kalor sebesar 150 kj dan menghasilkan gas yang akan menyebabkan terjadinya perubahan volume, sistem ini juga.
 Source: pintarnesia.com
Source: pintarnesia.com
Didalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (ch4) dengan oksigen berlebihan , sehingga terjadi reaksi, ch4(g) + 2 o2(g) — co2(g) + 2h2o (g) ternyata terjadi kenaikan suhu 1,56oc. Besarnya sebuah pergantian pada entalpi (δh) sama saja dengan besar dari panasnya reaksi, namun dengan rumus yang berbeda. Contoh soal, soal latihan dan soal evaluasi. Lima puluh gram airlima puluh gram air pada wadah lain dipanaskan, kemudian sesaat sebelum dimasukkan ke dalam kalorimeter suhunya diukur dan ternyata besarnya 70.5oc.
 Source: perpustakaancyber.blogspot.com
Source: perpustakaancyber.blogspot.com
Sebuah contoh khas adalah perubahan wujud materi, fase transisi seperti mencairnya es atau mendidihnya air. Contoh soal perubahan entalpi pembakaran standar isooktana pada pembakaran 570 gram isooktana (c 8 h 18 ) pada keadaan standar/stp dibebaskan kalor sebesar 27.500 kj. Lima puluh gram airlima puluh gram air pada wadah lain dipanaskan, kemudian sesaat sebelum dimasukkan ke dalam kalorimeter suhunya diukur dan ternyata besarnya 70.5oc. Reaksi kesetimbangan n 2 + 3h 2 ⇄2nh 3 menghasilkan 1 mol h 2 pada keadaan setimbang.
 Source: yuk.mojok.my.id
Source: yuk.mojok.my.id
C = kalor jenis air (4,18 j/gr.c) ∆t = perubahan suhu; Ba+2hcl→ bacl 2 + h 2. Menentukan besarnya energi yang diserap atau dibebaskan oleh air dengan kalorimeter. Reaksi kesetimbangan n 2 + 3h 2 ⇄2nh 3 menghasilkan 1 mol h 2 pada keadaan setimbang.
Black menggunakan istilah ini dalam konteks kalorimeter.
Berikut ini adalah beberapa contoh soal kalorimeter beserta pembahasannya yakni sebagai berikut: Energi yang berkait dengan pemutusan atau pembentukan ikatan kimia. Pengertian umum untuk kalorimeter adalah alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan atau reaksi kimia. Alat yang digunakan untuk mengukur perubahan. Di dalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (ch 4) dengan oksigen berlebih, sehingga terjadi reaksi sebagai berikut:
 Source: slideshare.net
Source: slideshare.net
Q air = m x c x ∆t. 100 ml larutan h 2 so 4 1 m direaksikan dengan 100 ml naoh 2 dalam suatu kalorimeter sederhana, ternyata suhu larutan naik dari 25 ºc menjadi 45 ºc. Entalpi pembakaran standar adalah perubahan entalpi untuk membakar setiap mol suatu zat yang diukur pada suhu 25 c dan tekanan 1 atm. Jika sepotong logam barium direaksikan dengan asam klorida encer pada sistem terbuka dengan reaksi: Hitunglah perubahan entalpi reaksi yang terjadi.
Black menggunakan istilah ini dalam konteks kalorimeter.
Termodinamika merupakan salah satu cabang fisika yang membahas mengenai perubahan energi panas menjadi bentuk energi lain. Dengan menggunakan hukum hess, kalor reaksi suatu reaksi kimia dapat ditentukan berdasarkan data perubahan entalpi pembentukan standar, energi ikatan dan secara eksperimen. Lima puluh gram airlima puluh gram air pada wadah lain dipanaskan, kemudian sesaat sebelum dimasukkan ke dalam kalorimeter suhunya diukur dan ternyata besarnya 70.5oc. Pada reaksi tersebut sistem melepas kalor sebesar 150 kj dan menghasilkan gas yang akan menyebabkan terjadinya perubahan volume, sistem ini juga.
 Source: yuk.mojok.my.id
Source: yuk.mojok.my.id
Jenis perubahan entalpi perubahan entalpi pembentukan (δhf) ialah pergantian entalpi yang membentuk 1mol senyawa yang terjadi akibat beberapa unsur yang disusun oleh keadaan standar. Isooktana (c 8 h 18 ) adalah salah satu komponen yang ada dalam bensin, Contoh soal perubahan entalpi pembakaran standar isooktana pada pembakaran 570 gram isooktana (c 8 h 18 ) pada keadaan standar/stp dibebaskan kalor sebesar 27.500 kj. Istilah ini diperkenalkan sekitar 1762 oleh joseph black.
 Source: soal-kelasmu.blogspot.com
Source: soal-kelasmu.blogspot.com
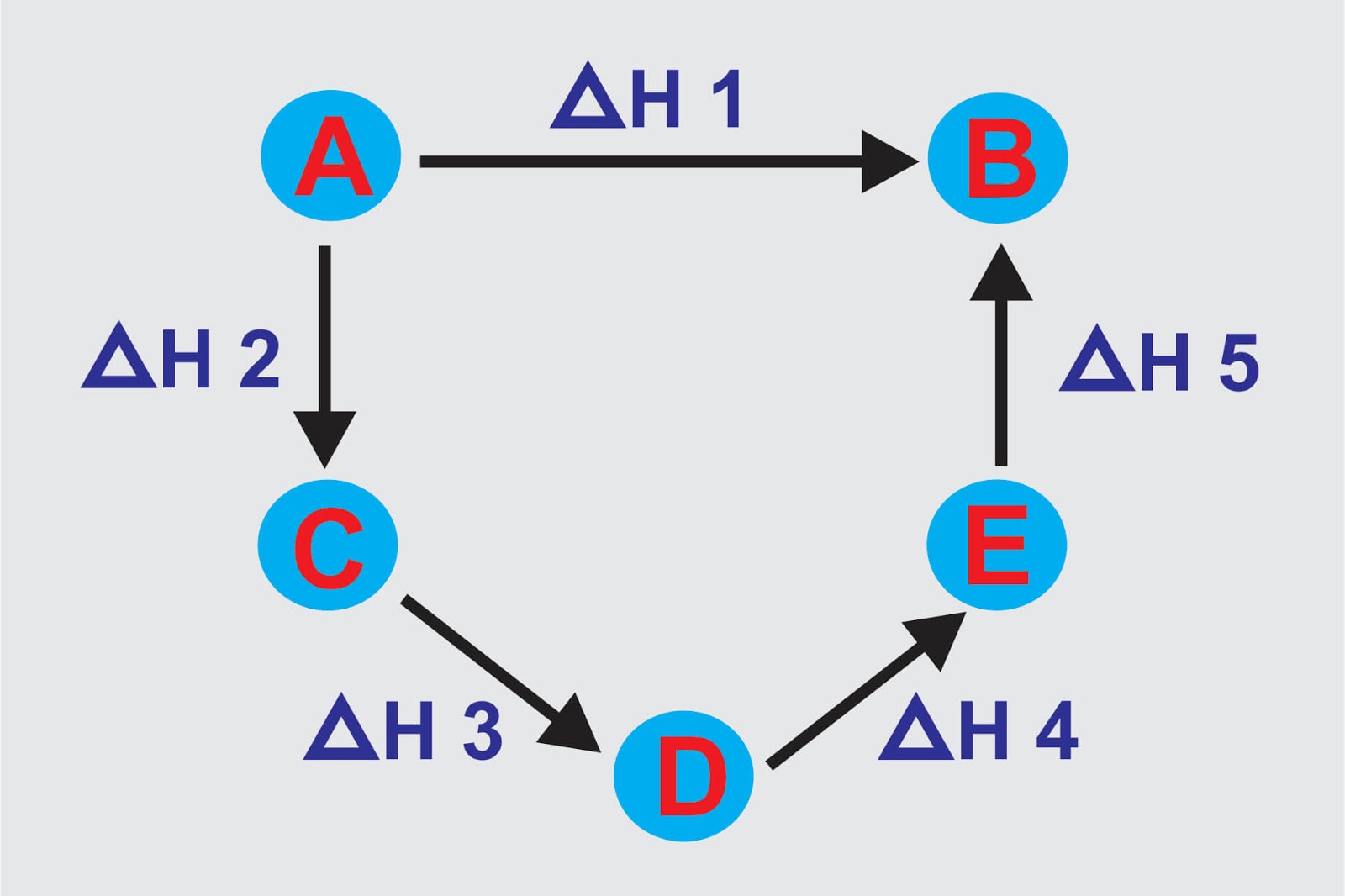
Maka perubahan entalpi reaksi tersebut sama dengan jumlah perubahan entalpi dari semua tahapannya energi ikatan : Sebuah contoh khas adalah perubahan wujud materi, fase transisi seperti mencairnya es atau mendidihnya air. Entalpi pembakaran standar adalah perubahan entalpi untuk membakar setiap mol suatu zat yang diukur pada suhu 25 c dan tekanan 1 atm. Penentuan perubahan entalpi dengan kalorimeter merupakan cara sederhana untuk menentukan perubahan entalpi dengan menggunakan satuan kalori.
 Source: yuk.mojok.my.id
Source: yuk.mojok.my.id
Besarnya sebuah pergantian pada entalpi (δh) sama saja dengan besar dari panasnya reaksi, namun dengan rumus yang berbeda. Isooktana (c 8 h 18 ) adalah salah satu komponen yang ada dalam bensin, Energi yang berkait dengan pemutusan atau pembentukan ikatan kimia. Tentukan entalpi pembakaran standar metanol (mr = 16) sebanyak 0,48 gram yang dibakar dalam kalorimeter yang berisi 500 gram air.
Alat yang digunakan untuk mengukur perubahan.
Proses dan cara menghitung perubahan entalpi atau entalpi reaksi $(\triangle\mbox{h})$, yakni selisih antara entalpi produk dan entalpi reaktan. Pada reaksi tersebut sistem melepas kalor sebesar 150 kj dan menghasilkan gas yang akan menyebabkan terjadinya perubahan volume, sistem ini juga. Dengan adanya pengembangan lead chamber process pada tahun 1746 dan proses leblanc, sehingga memungkinkan adanya produksi asam sulfat dan natrium karbonat dalam jumlah besar, maka reaksi kimia dapat diaplikasikan dalam industri. Apabila kalor jenis air 4,2 j/gr.ºc dan kalor kalorimetri 80 j/ºc maka tentukan δh reaksi : Penentuan perubahan entalpi dengan kalorimeter merupakan cara sederhana untuk menentukan perubahan entalpi dengan menggunakan satuan kalori.
 Source: soal-kelasmu.blogspot.com
Source: soal-kelasmu.blogspot.com
Besarnya sebuah pergantian pada entalpi (δh) sama saja dengan besar dari panasnya reaksi, namun dengan rumus yang berbeda. Tentukan entalpi pembakaran standar metanol (mr = 16) sebanyak 0,48 gram yang dibakar dalam kalorimeter yang berisi 500 gram air. Jika sepotong logam barium direaksikan dengan asam klorida encer pada sistem terbuka dengan reaksi: Dalam contoh di atas, perhatikan bahwa reaksi pembentukan yang kita gunakan untuk c 2 h 5 oh terbalik. Pengukuran perubahan entalpi suatu reaksi kadangkala tidak dapat ditentukan langsung dengan kalorimeter, misalnya penentuan perubahan entalpi pembentukan standar (dhf o )co.
Berikut ini adalah beberapa contoh soal kalorimeter beserta pembahasannya yakni sebagai berikut:
Reaksi kesetimbangan n 2 + 3h 2 ⇄2nh 3 menghasilkan 1 mol h 2 pada keadaan setimbang. Maka perubahan entalpi reaksi tersebut sama dengan jumlah perubahan entalpi dari semua tahapannya energi ikatan : Pengertian umum untuk kalorimeter adalah alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan atau reaksi kimia. (anggaplah bahwa massa jenis larutan 1 g/ml dan kalor jenis larutan 4,2 j/g k)
 Source: soal-kelasmu.blogspot.com
Source: soal-kelasmu.blogspot.com
Hukum pertama termodinamika dan hukum termodinamika kedua menjadi acuan dalam membahas mengenai perubahan energi. Contoh soal perubahan entalpi pembakaran standar isooktana pada pembakaran 570 gram isooktana (c 8 h 18 ) pada keadaan standar/stp dibebaskan kalor sebesar 27.500 kj. Berikut ini adalah beberapa contoh soal kalorimeter beserta pembahasannya yakni sebagai berikut: 1 dalam suatu eksperimen, didapati 50 Di dalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (ch 4) dengan oksigen berlebih, sehingga terjadi reaksi sebagai berikut:
 Source: yuk.mojok.my.id
Source: yuk.mojok.my.id
Black menggunakan istilah ini dalam konteks kalorimeter. Besarnya sebuah pergantian pada entalpi (δh) sama saja dengan besar dari panasnya reaksi, namun dengan rumus yang berbeda. Dengan adanya pengembangan lead chamber process pada tahun 1746 dan proses leblanc, sehingga memungkinkan adanya produksi asam sulfat dan natrium karbonat dalam jumlah besar, maka reaksi kimia dapat diaplikasikan dalam industri. Dalam contoh di atas, perhatikan bahwa reaksi pembentukan yang kita gunakan untuk c 2 h 5 oh terbalik. Perhitungan yang digunakan pada pada kalorimeter menggunakan perhitungan dari teori asas black dengan rumus:
 Source: perpustakaancyber.blogspot.com
Source: perpustakaancyber.blogspot.com
Dalam contoh di atas, perhatikan bahwa reaksi pembentukan yang kita gunakan untuk c 2 h 5 oh terbalik. Reaksi pembakaran selalu melibatkan gas oksigen (o 2) dan gas karbon dioksida untuk pembakaran sempurna atau gas karbon monoksida untuk pembakaran tidak sempurna.perhatikan contoh soal entalpi pembakaran. 100 ml larutan h 2 so 4 1 m direaksikan dengan 100 ml naoh 2 dalam suatu kalorimeter sederhana, ternyata suhu larutan naik dari 25 ºc menjadi 45 ºc. Agar kalian dapat lebih jelas memahami perhitungan perubahan entalpi berdasarkan percobaan menggunakan kalorimeter, berikut diberikan beberapa contoh soal. Contoh soal, soal latihan dan soal evaluasi.
Situs ini adalah komunitas terbuka bagi pengguna untuk menuangkan apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini baik, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga simpan halaman blog ini dengan judul contoh soal perubahan entalpi dengan kalorimeter dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.





